L’atome – Nucléides, isotopes et radioactivité
Toute la matière qui nous entoure est composée d’atomes. Un nucléide est un type d’atome, et les nucléides radioactifs sont appelés radionucléides. Les radionucléides du même élément sont appelés radio-isotopes.
Sur cette page
L’atome
Un atome est composé de protons et de neutrons, qui forment le noyau. Les électrons sont des particules chargées négativement qui se déplacent autour du noyau en formant un nuage périphérique. Les électrons négatifs sont attirés vers le noyau positif par une force électrique. C’est grâce à cette attraction que les électrons restent en orbite autour du noyau.
Les protons sont chargés positivement, alors que les neutrons sont neutres électriquement. Le noyau porte donc une charge positive.
C’est la grande force nucléaire qui maintient ensemble les protons et neutrons qui forment le noyau, malgré le fait que les protons se repoussent mutuellement.
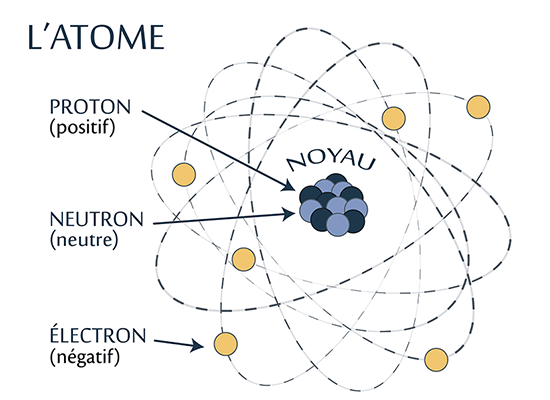
Chaque élément est identifié à l’aide d’un numéro atomique unique, qui est le même que le nombre de protons dans le noyau de chaque atome qui forme l’élément. Par exemple, il y a 6 protons dans le carbone; pour cette raison, son numéro atomique est 6 dans le tableau périodique des éléments.
Tableau périodique des éléments
Les atomes sont stables lorsque le nombre de neutrons dans le noyau est à peu près équivalent au nombre de protons (même si cela ne signifie pas qu’il y a toujours un nombre égal de neutrons et de protons dans le noyau). Lorsqu’il y a un déséquilibre important entre le nombre de neutrons et de protons dans le noyau, l’atome devient instable.
Pour retrouver sa stabilité, l’atome peut libérer de l’énergie sous forme de rayonnement ionisant, un processus qu’on appelle la désintégration radioactive.
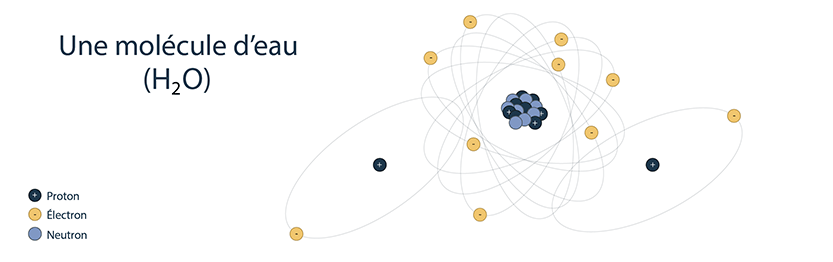
Les atomes d’un ou de plusieurs éléments peuvent se combiner entre eux pour former un composé plus volumineux portant le nom de molécule. Une molécule d’eau (H2O), par exemple, est constituée de 2 atomes d’hydrogène (H) combinés à 1 atome d’oxygène (O).
Le nucléide
Un nucléide est un type d’atome spécifique caractérisé par le nombre total de protons et de neutrons qui composent le noyau. Ce numéro correspond approximativement à la masse du nucléide et est appelé nombre de masse.
Le nombre de masse d’un nucléide est mesuré en unités de masse atomique (uma). Par exemple, le carbone 12 a 6 protons et 6 neutrons et une masse de 12 uma.

Les isotopes
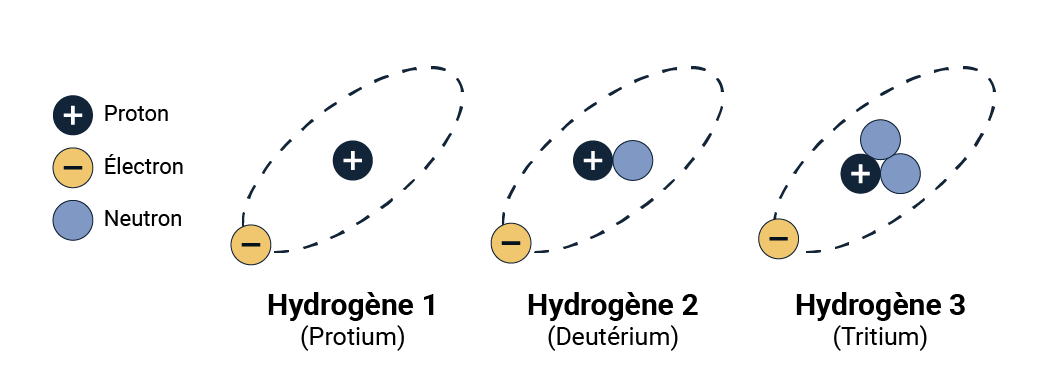
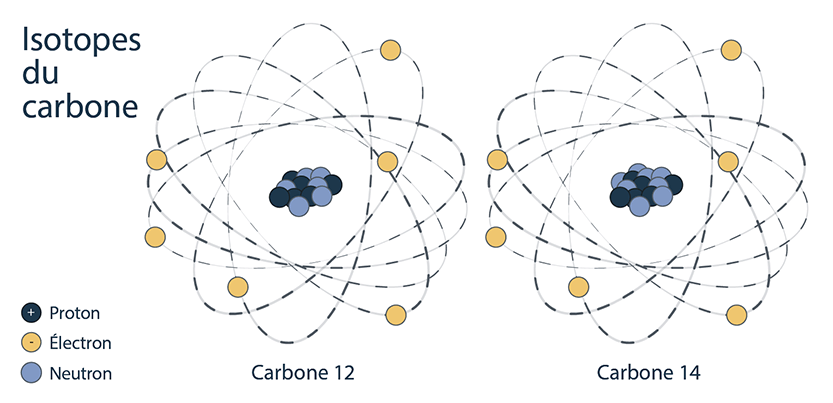
Les nucléides d’un élément qui ont le même nombre de protons, mais un nombre différent de neutrons sont appelés des isotopes de cet élément. Il s’agit de variantes du même élément de base. Par exemple, il existe 3 isotopes (ou variantes) de l’hydrogène :
- l’hydrogène 1, ou protium, qui comprend 1 proton et aucun neutron
- l’hydrogène 2, ou deutérium, qui comprend 1 proton et 1 neutron
- l’hydrogène 3, ou tritium, qui comprend 1 proton et 2 neutrons
Isotopes de l’hydrogène
Les isotopes de l’uranium comprennent :
- l’uranium 235, formé de 92 protons et 143 neutrons
- l’uranium 238, formé de 92 protons et 146 neutrons
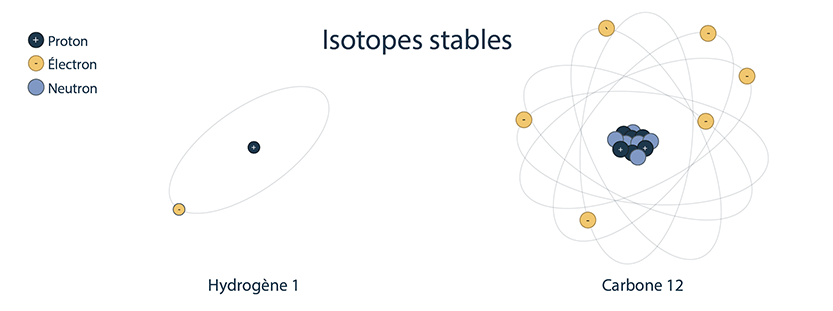
Isotopes stables
De nombreux isotopes sont stables. Ils ne subissent pas de désintégration radioactive et n’émettent pas de rayonnement. Un isotope est stable lorsqu’il y a un équilibre entre le nombre de neutrons et le nombre de protons. Toutefois, cela ne signifie pas toujours qu’il y a un nombre égal de neutrons et de protons.
Lorsqu’un isotope est petit et stable, il contient pratiquement le même nombre de protons que de neutrons. Les isotopes stables plus volumineux ont légèrement plus de neutrons que de protons. La force de répulsion est donc équilibrée par les protons chargés positivement qui se trouvent proches les uns des autres.
Un exemple d’isotope stable est le carbone 12, qui a 6 protons et 6 neutrons, pour une masse totale de 12 uma.
Isotopes instables
Un isotope instable est un atome dont le noyau est instable en raison d’un déséquilibre entre le nombre de protons et de neutrons. Les isotopes instables sont radioactifs, et donc appelés radio-isotopes.
Le déséquilibre se produit souvent lorsque le ratio entre neutrons et protons est trop bas. Lorsque cela se produit, l’atome perd de l’énergie en émettant du rayonnement ionisant afin de se transformer en forme plus stable. L’atome réduit ainsi sa masse et devient un élément différent. Certains atomes peuvent aussi atteindre la stabilité par d’autres moyens, comme la fission nucléaire spontanée.
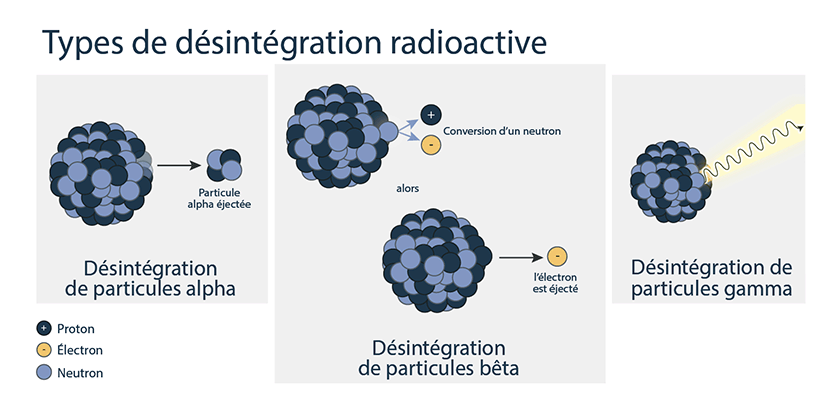
Ce processus spontané qui émet de l’énergie s’appelle la désintégration radioactive. De l’énergie peut être émise sous forme de particules alpha, de particules bêta (électrons et positrons) et/ou de rayons gamma. Il existe 3 grands types de désintégration radioactive :
- désintégration alpha
- désintégration bêta
- désintégration gamma
Désintégration alpha
Lorsqu’un atome subit une désintégration alpha, il éjecte du noyau une particule composée de 2 protons et de 2 neutrons.
Ceci a pour résultat que le numéro atomique diminue de 2 et la masse diminue de 4.
Désintégration bêta
Le type de désintégration bêta le plus courant se produit lorsqu’un neutron se convertit en proton en émettant 1 électron du noyau de l’atome.
Le numéro atomique (nombre de protons) augmente de 1, mais la masse ne diminue que légèrement puisque les électrons ne contribuent que peu à la masse d’un atome.
Désintégration gamma
La désintégration gamma est la libération de l’énergie excédentaire présente dans le noyau après une désintégration alpha ou bêta. L’énergie résiduelle est émise sous forme de photon de rayons gamma. La désintégration gamma n’affecte généralement pas la masse ni le numéro atomique du nucléide.
La désintégration gamma peut aussi se produire après la capture des neutrons dans un réacteur nucléaire.
Les radionucléides
Lorsqu’un nucléide se désintègre spontanément, l’énergie excédentaire qui est émise est une forme de rayonnement ionisant appelée « T », autrement dit, l’activité. Le nucléide qui se transforme et émet un rayonnement porte le nom de radionucléide.
La désintégration est exprimée ou mesurée en unités appelées becquerels (Bq), et 1 Bq correspond à 1 désintégration par seconde.
Période radioactive
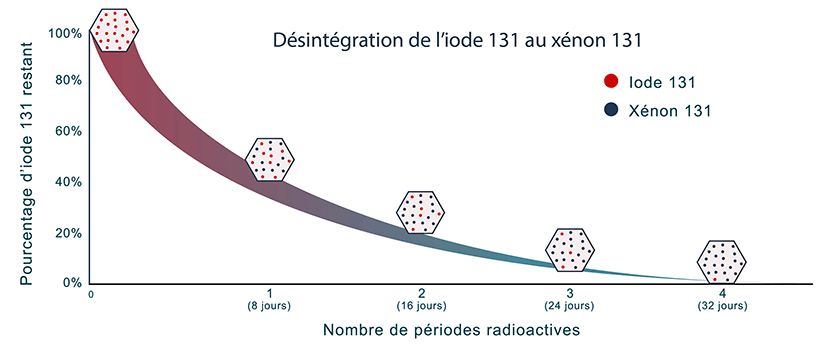
La période radioactive, ou demi-vie, est le temps nécessaire pour que l’activité initiale d’un radionucléide soit réduite de moitié par un processus de décroissance radioactive.
Chaque radionucléide a une période radioactive unique qui peut varier entre une fraction de seconde et plusieurs milliards d’années. Par exemple, il faut 8 jours pour que l’activité d’origine de l’iode 131 soit réduite de moitié, alors qu’il faut 24 000 ans pour le plutonium 239.
Le symbole qui désigne la période radioactive est t½. Si la source originelle de la radioactivité est connue, il est possible de calculer le temps nécessaire à sa désintégration. L’inverse est également vrai. Si la période radioactive est connue, il est alors possible d’identifier le radionucléide.
Activité massique
L’activité massique désigne l’activité (la vitesse de désintégration d’un nucléide qui émet du rayonnement, ou le nombre de désintégrations par seconde) par unité de masse d’un radionucléide.
Il existe une relation inversement proportionnelle entre la période radioactive et l’activité massique. Les radionucléides dont la période radioactive est plus courte émettront plus de rayonnement.
Le cobalt 60, par exemple, a une période radioactive plus courte que l’uranium 238 et émet plus de rayonnement par seconde par gramme. Il se désintègre plus vite que l’uranium 238, qui émet moins de rayonnement par seconde par gramme.
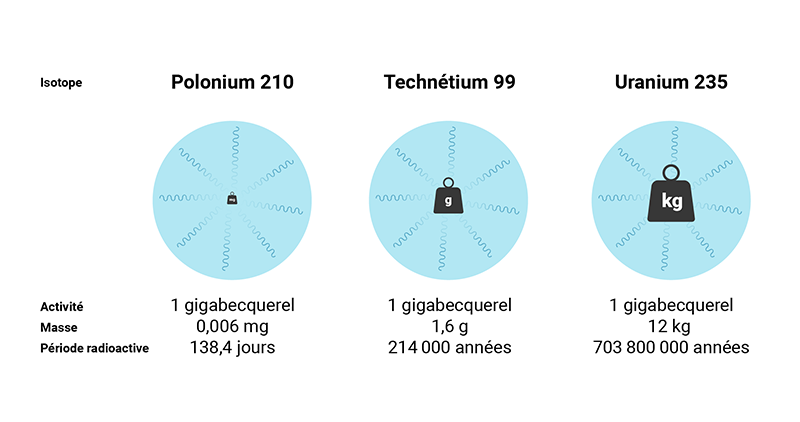
Le tableau suivant présente une comparaison entre différents radionucléides ayant différentes périodes radioactives et montre la relation inverse entre la période radioactive et l’activité massique. La dernière colonne indique la quantité d’isotopes requise en milligrammes pour obtenir 1 mégabecquerel d’activité. L’activité massique est exprimée en becquerels par gramme, et dépend de la période radioactive ainsi que de la masse atomique de chaque radionucléide.
| Radionucléide | Période radioactive | Activité massique* | Milligrammes (mg) par mégabecquerels (MBq) |
|---|---|---|---|
| Polonium 210 | 138,4 jours | 166,3E 12 (166,3 TBq/gr) | 0,000006 |
| Cobalt 60 | 5,3 années | 41,9E 12 (41,9 TBq/gr) | 0,0000239 |
| Césium 137 | 30,04 années | 3,2E 12 (3,2 TBq/gr) | 0,0003109 |
| Carbone 14 | 5 700 années | 165,7E 9 (165,7 GBq/gr) | 0,006 |
| Technétium 99 | 214 000 années | 624,9E 6 (624,9 MBq/gr) | 1,6 |
| Uranium 235 | 703,8 millions d’années | 80,0E 3 (80,0 kBq/gr) | 12 000,5 |
| Uranium 238 | 4,468 milliards d’années | 12,4E 3(12,4 kBq/gr) | 80 000,4 |
*TBq : térabecquerel (1 billion de Bq)
GBq : gigabecquerel (1 milliard de Bq)
MBq : mégabecquerel (1 million de Bq)
kBq : kilobecquerel (1 000 Bq)
Sources naturelles et artificielles de radionucléides
Il existe de nombreuses sources naturelles de radionucléides. Leur origine remonte à la formation du système solaire. Certains radionucléides, comme le tritium, proviennent de l’interaction entre les rayons cosmiques et les molécules dans l’atmosphère.
Certains radionucléides qui se sont formés au même moment que notre système solaire, comme l’uranium et le thorium, ont des demi-vies de plusieurs milliards d’années et continuent d’être présents dans notre environnement.
Les radionucléides sont aussi créés en tant que sous-produit de l’exploitation des réacteurs nucléaires et dans les générateurs de radionucléides comme les cyclotrons. Plusieurs radionucléides de sources artificielles sont utilisés :
- en médecine nucléaire et en biochimie
- par l’industrie de la fabrication
- en agriculture
Liens connexes
- Introduction au rayonnement : sujets de base
- Qu’est-ce que le rayonnement?
- Les principes de base du rayonnement ionisant
- Sûreté nucléaire
- Sources radioactives utilisées de façon sécuritaire
- Loi sur la sûreté et la réglementation nucléaires (site Web de la législation – Justice)
- Radiation, People and the Environment (Agence internationale de l’énergie atomique, en anglais)
Détails de la page
- Date de modification :